斯文氧化反應
斯文氧化反應(Swern氧化反應),現代有機合成常用反應,由美國化學家Daniel Swern發現。反應利用二甲基亞碸(DMSO)做氧化劑和有機鹼(如三乙胺)在低溫下與草酰氯協同作用將一級醇或二級醇氧化成醛或酮的反應。[1][2][3] 這個反應的條件溫和對於底物的官能團耐受性好,適用範圍廣泛,是有機合成中一個不依靠含金屬氧化劑的氧化反應。[4][5][6][7]
1976年, D.Swern以及同事發現了當二甲亞碸和三氟乙酸酐在低溫處理以後和一級醇或者二級醇反應能形成一種中間體, 而其繼續和三乙胺處理以後能得到相應高收率的醛酮。 後來1978年,又報道了用草酰氯能代替三氟乙酸酐更高效的進行反應。[8]

斯文氧化反應的第一步是低溫下,二甲基亞碸(1a)共振形成(1b)並與草酰氯(2)的親核加成,生成第一個中間體(3)。此中間體迅速的分解為CO2和CO,並生成氯化二甲基氯代鋶鹽(4)。
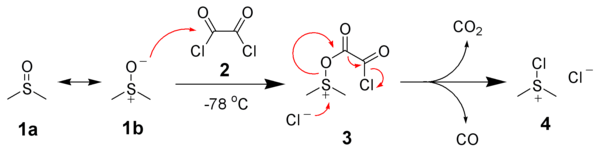
當加入醇以後,鋶鹽(4)與加入的醇(5)反應生成關鍵的烷氧基鋶離子中間體(6)。在加入了兩當量的鹼後,發生去質子作用生成硫葉立德(7)。通過一個五元環的過渡態,硫葉立德(7)進一步分解為二甲基硫醚以及產物——酮(或醛)(8)。[9][10][11]

使用草酰氯作為脫水試劑時為了減少副反應,反應溫度必須得低於-60℃,如果使用三氟乙酸酐替換草酰氯,則反應溫度允許在-30℃而不產生副產物。某些用來活化DMSO來引發反應的關鍵中間體(6)使用的是:碳二亞胺(Pfitzner–Moffatt氧化)和吡啶-硫三氧化二砷絡合物(Parikh-Doering氧化)。反應中間體(4)還可以通過DMSO和N-氯代丁二酰亞胺製備(Corey-Kim氧化)。
使用三乙基胺可能會導致發生在新生成羰基α位的差向異構體,這時可以使用位阻更大的鹼來減少這種副反應,例如N,N-二異丙基乙基胺(i-Pr2NEt, Hünig鹼)。二環己基碳二亞胺 (DCC,Pfitzner-Moffat反應)、乙酸酐、三氧化硫-吡啶絡合物 (SO3·py)亦可作為二甲亞碸的活化劑,其中三氧化硫-吡啶絡合物的反應(Parikh-Doering反應)可在 0℃進行。
此反應的副產物為二甲基硫醚(Me2S)(帶有在有機化學中著名的惡臭氣味。人類的嗅腺能夠分辨出濃度為十億分之一的二甲基硫醚)、一氧化碳(CO)和二氧化碳(CO2),當使用三乙基胺的時候還會生成三乙胺鹽酸鹽(Et3NHCl)。其中,二甲基硫醚和一氧化碳均為揮發性物質,且有劇毒,因此,此反應的後處理是需要在通風櫥里進行。二甲基硫醚也有強烈的令人不愉快的氣味,可以將粗產品與過硫酸氫鉀混合將其氧化為二甲基亞碸,消除這種臭味(但要注意在低溫進行,防止醛被氧化)。
反應一般使用二氯甲烷做溶劑,如在反應體系中不使用溶劑,DMSO(二甲亞碸)與TFAA(三氟乙酸酐)或草酰氯會發生劇烈反應(爆炸!),故在進行該反應時必須非常注意安全問題。
反應溫度選擇:當使用TFAH(三氟乙酸酐)的時候反應中間體需在-30℃內反應,當使用草酰氯時,則需要降低至-60℃(而通常選擇的是乾冰丙酮浴即-78℃)
空間位阻:空阻影響對於斯文氧化反應影響非常小
在應用當中,斯文氧化反應能夠針對一些酸敏感的底物,這些底物通常在其他的酸性氧化條件下會分解(比如Jones 氧化)。比如在Thompson & Heathcock的倍半萜烯合成當中,最後一步的Swern 氧化能夠避免酸敏感的三元環連接的甲羥基發生副反應。[12]

- ↑ Omura, K.; Swern, D. Tetrahedron 1978, 34, 1651. (doi:10.1016/0040-4020(78)80197-5)
- ↑ Mancuso, A. J.; Huang, S.-L.; Swern, D. J. Org. Chem. 1978, 43, 2480–2482. (doi:10.1021/jo00406a041)
- ↑ Mancuso, A. J.; Brownfain, D. S.; Swern, D. J. Org. Chem. 1979, 44, 4148. (doi:10.1021/jo01337a028)
- ↑ Dondoni, A.; Perrone, D. Org. Syn., Coll. Vol. 10, p.320 (2004); Vol. 77, p.64 (2000). (Article)
- ↑ Bishop, R. Org. Syn., Coll. Vol. 9, p.692 (1998); Vol. 70, p.120 (1992). (Article)
- ↑ Leopold, E. J. Org. Syn., Coll. Vol. 7, p.258 (1990); Vol. 64, p.164 (1986). (Article)
- ↑ Gabriel Tojo and Marcos Fernández. Oxidation of Alkohols to Aldehydes and Ketones: A Guide to Current Common Practice. Springer, 2006.
- ↑ Omura, K., Sharma, A. K., Swern, D. Dimethyl sulfoxide-trifluoroacetic anhydride. New reagent for oxidation of alcohols to carbonyls. J. Org. Chem. 1976, 41, 957-962.
- ↑ Mancuso, A. J., Swern, D. Activated dimethyl sulfoxide: useful reagents for synthesis. Synthesis 1981, 165-185.
- ↑ Tidwell, T. T. Oxidation of alcohols by activated dimethyl sulfoxide and related reactions: an update. Synthesis 1990, 857-870.
- ↑ Tidwell, T. T. Oxidation of alcohols to carbonyl compounds via alkoxysulfonium ylides: the Moffat, Swern, and related oxidations. Org. React. 1990, 39, 297-572.
- ↑ Thompson, S. K.; Heathcock, C. H. Total synthesis of some marasmane and lactarane sesquiterpenes. J. Org. Chem. 1992, 57 (22): 5979–5989. doi:10.1021/jo00048a036.
