自由基

自由基(英語:Free Radical),又稱游離基,是指化合物的分子在光熱等外界條件下,共價鍵發生均裂而形成的具有不成對電子的原子或基團。 在書寫時,一般在原子符號或者原子團符號旁邊加上一個「·」表示沒有成對的電子。如氫自由基(H·,即氫原子)、氯自由基(Cl·,即氯原子)、甲基自由基(CH3·)和四甲基哌啶氧自由基等。[1]自由基極易發生反應(如二聚反應、奪氫反應、氧化反應、歧化反應等)。機體氧化反應中產生的有害化合物,具有強氧化性,可損害機體的組織和細胞,進而引起慢性疾病及衰老效應。自由基可以是帶正電荷,負電荷或者不帶電荷。雖然金屬以及它們的離子或者它們的絡合物有不成對的電子,但按照常規習慣定義不算是自由基。[2] 除了極個別情況, 大多數的未成對電子形成的自由基都具有較高的化學活性。如果體內含有自由基,被認為會導致退化性疾病和癌症。
自由基反應在燃燒、氣體化學、聚合反應、等離子體化學、生物化學和其他各種化學學科中扮演很重要的角色。在化學生物學當中,過氧化物和一氧化氮調節著許多生物過程比如控制血管張力。這樣的自由基可以作為一種稱為氧化還原信號當中的信使。自由基可被溶劑籠包圍。
歷史上第一個被發現和證實的自由基是由摩西·岡伯格在1900年於密西根大學發現的三苯甲基自由基。
歷史上,詞組「自由基」是用來命名作為連接分子的不同部分, 特別是當它們在反應過程中保持不變的時候。這些我們現在稱為:官能團。 比如,甲醇以前認為是由甲基「自由基」和羥基「自由基」所組成的。而現在甲醇在現在化學的理論中不認為具有自由基,它們既沒有不成對的電子也沒有活性的電子,因為它們(羥基和甲基)永遠都是鍵合在一起的。 但是在質譜當中我們則可以觀察到在高能電子的轟擊下,甲醇分子被斷裂成羥基或者甲基的碎片自由基。
在化學方程式當中, 自由基最通常被表示為在原子或者分子式旁邊的一個點,比如:
- 氯氣在紫外線的照射下形成氯原子的自由基。
自由基 反應機理 使用單箭頭來描述單電子的轉移過程:
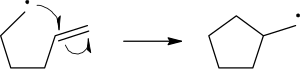
要斷裂化學鍵的裂解,使用類似於魚鉤一樣的單箭頭(區分於成對電子的雙箭頭)來表述。 這裡要提示的是: 斷開化學鍵的第二個電子也是和進攻自由基的單電子成對的, 而這裡則不明確的表述出來。
自由基作為反應中間體參與了自由基加成反應和自由基取代反應。 含有自由基的鏈式反應可以通常被分割成三個不同的過程:「鏈引發」, 「鏈增長」, 「鏈終止」。
- 鏈引發 階段,反應中呈現自由基的淨增長。 它可以像反應1一樣從穩定的形態來生成自由基,也可以是從自由基的形成反應當中來生成更多的自由基。
- 鏈增長 階段,反應當中生成了大量自由基,而自由基的總數量是保持不變的。
- 鏈終止 階段,反應總體呈現了自由基的淨減少。 兩種自由基互相形成一種更穩定的物質, 比如: 2Cl·→ Cl2
例如:甲烷和氯氣取代反應的歷程[3]
- 鏈引發:氯分子在光的作用下,分解成兩個氯原子(氯自由基)。從而引發反應
- 鏈增長: 極活潑的Cl·奪取甲烷分子中的一個氫原子,生成甲基自由基(CH3·)和氯化氫。活潑的CH3·自由立即再與氯分子反應,生成氯甲烷並生成一個新的自由基(Cl·)。該自由基又重新與CH4反應。如此反覆循環,引起連鎖反應。
- 鏈終止:當反應中的CH3Cl濃度增高,Cl·游離基將與CH3Cl生成CH2Cl·,並按上述類似過程生成CH2Cl2。進而生成CHCl3、CCl4等。當烷烴消耗完後,Cl·和其自身碰撞的機會增加,生成Cl2分子,其他自由基也可以相互結合生成穩定的分子,反應便告終止。
自由基的形成可以是由於共價鍵的均裂,其過程需要較高的能量。 比如一個H2分子轉化為 2H· 需要 而一個Cl2分子轉化為 2Cl· 需要。 這就是我們所說的鍵離解能, 它通常被簡寫為:。 兩個原子連接形成的共價鍵的鍵能是由整個分子的結構決定的,而並非僅僅與這兩個原子有關。形成自由基其實需要更多的能量。化學鍵的均裂經常發生在兩個具有相近電負性的原子之間。在有機化學當中經常是過氧化物當中的 O-O 鍵或者 O-N 鍵。有時候,由於附加的能壘,自由基的形成也可能是自旋禁阻的。
然而,鏈增長過程是一個非常劇烈的放熱反應。 這裡需要注意的是,雖然自由基離子也是存在的,但是大多數的物質都是電中性的。
自由基還可以通過一個原子或者分子的氧化還原過程來形成。
燃燒是最常見的自由基反應。氧分子是一種穩定的雙自由基(可以表示為·O-O)。因為電子自旋平行,氧分子很穩定。當穩定基態氧分子(三線態氧)激發後,形成極度活潑的的單線態氧。為了使燃燒進行,必須跨越能壘。能壘的跨越需要較高的溫度。三線態氧到單線態氧的轉換是被"禁止的"。
- ↑ 周公度主編. 化学词典. 北京: 化學工業出版社. 2010: 62. ISBN 978-7-122-07817-9.
- ↑ Red Book, IUPAC Recommendations 2005 Nomenclature of Inorganic Chemistry p.66, Formulae of radicals
- ↑ 齊欣、高鴻賓主編. 有机化学简明教程. 天津: 天津大學出版社. 2011: 21. ISBN 9787561839713.










